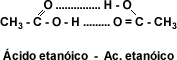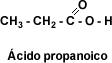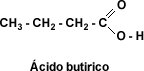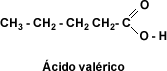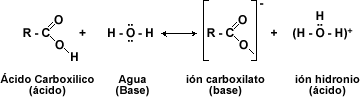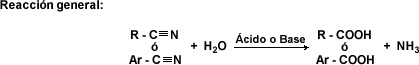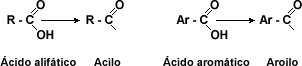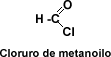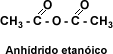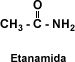Creado por: Laura Andrea Carreño Ribero
Curso: 11-2 T
Los ácidos carboxílicos son compuestos orgánicos que contienen uno, dos o más grupos carboxilo (—COOH o —CO2H).
El más simple es el ácido metanoico (ácido fórmico), y uno de los más familiares es el ácido etanoico (ácido acético), que en estado diluido e impuro forma parte del vinagre. Los ácidos carboxílicos con un único grupo carboxilo y, generalmente, de cadena lineal se denominan ácidos grasos; la cadena hidrocarbonada puede ser saturada o bien contener uno o más enlaces dobles. Muchos ácidos carboxílicos son esenciales en la química de los organismos vivos. Otros son productos químicos de gran importancia industrial.
El nombre de los ácidos carboxílicos comienza con la palabra “ácido” seguida por el nombre del alcano básico terminado en “oico”. Para los ácidos alifáticos, el carbono uno corresponde al carbono carboxilo. Los ácidos mas frecuentes se conocen por sus nombres comunes, por ejemplo Ácido metanoico o fórmico, HCOOH; Ácido etanoico o Ácido acético, CH3 - COOH; Ácido propanoico o propiónico, CH3 - CH2 - COOH; Ácido butanoico o butírico, CH3 - CH2 - CH2 - COOH.
PROPIEDADES FISICAS
Los ácidos de masa molar baja (hasta diez átomos de carbono) son líquidos incoloros, de olor muy desagradable. El olor del vinagre se debe al ácido acético; el de la mantequilla rancia al ácido butírico. El ácido caproico se encuentra en el pelo y secreciones del ganado caprino. Los ácidos C5 a C10 poseen olores a “cabra”. El resto sólidos cerosos e inodoros a temperatura ambiente. Sus puntos de fusión y ebullición crecen al aumentar la masa molar.
Los ácidos inferiores son solubles en agua; su solubilidad decrece a partir del ácido butírico con el aumento del carácter hidrocarbonado de la molécula. Todos los ácidos son solubles en solventes orgánicos
Estructura
La fórmula electrónica de un ácido carboxílico se representa de la forma siguente:

La densidad electrónica del enlace — C = O, está desplazada hacia el átomo de oxígeno más electronegativo adquiriendo este una carga parcial negativa. A la vez en el enlace oxígeno-hidrógeno hay un desplazamiento electrónico hacia el átomo de oxígeno, lo que permite la salida del hidrogeno como protón:

Cuando se ioniza un ácido carboxílico, el anión carboxilato que se produce tiene una carga negativa deslocalizada y compartida entre los dos átomos de oxígeno.
Los ácidos carboxílicos en general tienen una Ka de10-5 a 10-3, y son más ácidos que los alcoholes y el agua (Ka del orden de 10-8 y 10-14 respectivamente)
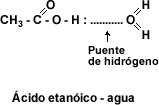
El grupo hidroxilo permite la formación de asociaciones moleculares por puente de hidrógeno, que se pueden representar de la forma siguiente:

La asociación de dos moléculas (dímero) mediante un puente de hidrógeno hace que la temperatura de ebullición sea mayor que la de compuestos heterólogos (sustancias que presentan el mismo número de carbonos y pertenecen a funciones diferentes). La presencia en estos compuestos del grupo funcional carboxilo, así como la característica de la cadena carbonada, son factores determinantes de las propiedades físicas.
La irregularidad de las temperaturas de fusión presentada en la tabla está relacionada con el modo en que se disponen las moléculas cuando el compuesto adquiere el estado sólido. En las moléculas con número par de átomos de carbono, los grupos carboxilo y metilo terminales, están situados en lados opuestos de la cadena carbonada dispuesta en zigzag, lo que permite, que las moléculas se dispongan más juntas en el retículo, razón por la cual aumentan las fuerzas de atracción intermoleculares y la temperatura de fusión.
Los ácidos que tienen hasta cuatro átomos de carbono son solubles en agua, esta propiedad disminuye con el aumento de la cadena y, por tanto la masa molar, ya que predomina en la molécula la porción de hidrocarburo con respecto al grupo carboxilo. Por ello, el ácido de cinco átomos de carbono ya es poco soluble en agua y los demás son prácticamente insolubles en ella.
PROPIEDADES QUIMICAS
Acidez
La reacción más característica de los ácidos carboxílicos es su ionización

Esta ionización se atribuye al desplazamiento electrónico a lo largo del doble enlace del grupo carbonilo hacia el átomo de oxígeno, dejando una carga positiva parcial sobre el átomo de carbono, provocando un desplazamiento inductivo a lo largo de los enlaces C - O y O - H, en sentido opuesto al átomo de hidrógeno, que puede ser extraído por interacción con una base. Por otra parte, el anión producido por la pérdida de un protón es un híbrido de resonancia de dos estructuras canónicas. La deslocalización de la carga estabiliza el anión, por lo que este puede formarse con mayor facilidad Ácidos Carboxílicos
Entre los ácidos alifáticos monocarboxílicos a medida que aumenta el número de carbonos disminuye su acidez porque los grupos hidrocarbonados son donadores de electrones, lo que hace que a mayor número de carbonos se fortalezca el enlace O - H y disminuye la facilidad de la liberación del ión hidrógeno.
Reacción de neutralización
Los ácidos carboxílicos sencillos son ácidos débiles que al reaccionar con bases fuertes, como el hidróxido de sodio, originan sales estables que son sólidos solubles en agua y se hallan completamente disociadas en solución. Son sales iónicas A las sales orgánicas se les nombra de la misma manera que a las sales inorgánicas. Al nombre del anión orgánico le sigue el nombre del catión. El nombre del anión se obtiene eliminando la terminación “ico” de los ácidos y reemplazándola por la terminación “ato”. Esto se aplica tanto a los nombres comunes como a los nombre IUPAC. El acetato de sodio, CH3 - COONa, se usa principalmente como vehículo para administrar un catión, también puede emplearse como alcalinizante porque se metaboliza con rapidez.
El acetato de potasio, CH3 - COOK, se emplea para reparar la deficiencia de potasio. Los propionatos de sodio y calcio se incorporan a la masa del pan como inhibidores no tóxicos del crecimiento de mohos. El propionato sódico se utiliza para tratar dermatomicosis, al igual que el ácido caprílico y sus sales. El undecilenato de zinc es un polvo blanco fino que tiene propiedades antimicóticos. El palmitato y el estearato de sodio son los constituyentes detergentes de los jabones. El benzoato de sodio se emplea como conservador de alimentos.
Reacción de los ácidos carboxílicos con amoniaco
Los ácidos carboxílicos reaccionan con el amoniaco formando amidas, en una reacción muy lenta a la temperatura ambiente. Primero se forma la sal de amonio y se separa el agua si la reacción se mantiene por encima de los 100 ºC. La ecuación general es:

Formación de haluros de acilo
Los ácidos carboxílicos reaccionan con ciertos halogenuros de no metales (como el fósforo) para formar halogenuros de acilo. Para la obtención de los cloruros, los más empleados son el PX3, PX5 y SOX2. Las reacciones son las siguientes

Los cloruros de acilo alifáticos son líquidos muy reactivos, de punto de ebullición inferior al del ácido carboxílico correspondiente. Al igual que otros muchos compuestos halogenados de gran reactividad, son lacrimógenos y causan quemaduras graves en contacto con la piel. Al aire emiten humos pálidos de cloruro de hidrógeno, debido a su reacción con el vapor de agua atmosférico. Los grupos acilos se nombran con el mismo del ácido de donde provienen eliminando la teminación “ico” y reemplazándola por “ilo”.
Formación de anhídridos orgánicos
De acuerdo a su estructura, se considera que los anhídridos de ácido se forman por eliminación de una molécula de agua entre dos moléculas de ácido. La reacción general de la formación de un anhídrido orgánico es

Los anhídridos de ácido se pueden obtener, también, por reacción entre el cloruro de acilo y una sal carboxílica. Los anhídridos de los ácidos alifáticos inferiores son líquidos de olores penetrantes, escasamente solubles en agua. Los anhídridos de ácido reaccionan con los mismos reactivos que los ésteres, pero con una reactividad intermedia entre la de los ésteres y la de los cloruros de acilo.
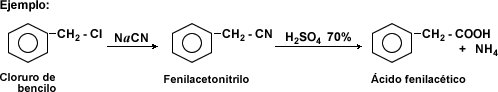
Formación de nitrilos
Los nitrilos se consideran derivados de los ácidos carboxílicos puesto que tienen el mismo estado de oxidación. Su fórmula general es R -CN y se nombran como ésteres del ácido cianhídrico o como cianoderivados de los hidrocarburos. Por ejemplo, el propionitrilo o cianuro de n-propilo es de fórmula CH3 - CH2 - CH2 - CN
Una forma de obtener nitrilos es mediante la deshidratación de amidas u oximas en presencia de pentóxido de fósforo, de acuerdo a la siguiente reacción:

Los nitrilos son sólidos o líquidos neutros. Los nitrilos alifáticos de pocos átomos de carbono son solubles en agua. Son compuestos covalentes y su toxicidad no es tan elevada como la de los cianuros iónicos, ya que no producen ácido cianhídrico por hidrólisis. La hidrólisis ácida de los nitrilos produce, primero, la amida correspondiente y, si prosigue, se obtiene el correspondiente ácido carboxílico.
El grupo nitrilo se encuentra en glucósidos vegetales y en la vitamina B12. La deficiencia de vitamina B12 puede producir anemia megalobástica, leucopenia y trombocitopenia. Una dieta vegetariana estricta, que incluya huevos y leche, no posee virtualmente nada de vitamina B12.
Reducción de ácidos carboxílicos
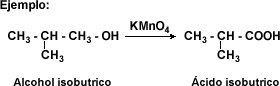
La reducción de ácidos carboxílicos es muy difícil. El hidruro de aluminio y litio reduce los ácidos carboxílicos a los alcoholes correspondientes en condiciones suaves
Reconocimiento de los ácidos carboxílicos: Prueba del yodato-yoduro
Es una reacción característica de los ácidos carboxílicos, que produce yodo molecular, que reconocemos por la coloración azul que adquiere el medio de la reacción al agregarle una solución de almidón. El ácido se combina con una mezcla de yodato de potasio, KIO3, y yoduro de potasio, KI, y se produce la siguiente reacción:

USOS
se utilizan los acidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.Además se usan como antitranspirantes y como neutralizantes, tambien para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
Ácido Fórmico:
Se utiliza como conservador en la industria cervecera y vitivinícola.
Se emplea en el teñido de telas y en curtiduría.

Ácido Acético:
(vinagre):Es el más usado. Se emplea para preparar acetona, rayón, solvente de lacas y resinas.
Con el ácido salicílico forma la aspirina.










El acido acético, se emplea como disolvente y en la fabricación en una gran variedad de productos químicos orgánico: plásticos, gomas, drogas, entre otras. también se utiliza en la industria del cultito de colorantes.
El acido cítrico, que provee el sabor agrio a los frutos cítrico, es un importante intermediario del metabolismo de los carbohidratos, y se emplea comercialmente en grandes cantidades como acidificante de bebidas refrescante.
El acido butanoico (butírico), presente en la mantequilla, se emplea para fabricar perfumes sintéticos, saborizantes y aditivos alimenticios.
La aspirina también es un acido carboxílico (acido acetilsatisilirico) su popularidad se debe a sus propiedades analgésicas, antipirereticas y antifamatorias, se utilizan, además, como drogas anticoagulante, para prevenir la formación de coágulos sanguíneos.
http://jeisonzapata.bligoo.com/content/view/3823605/aplicacion-del-acido-carboxilico-en-las-industrias-de-vinagre.html#.UiOIQ9IyJOI
http://profesionseg.blogspot.com/2007/05/riesgos-de-los-acidos-inorganicos.html
http://www.slidefinder.net/i/iod%C3%B3foros/32438139/p2
http://acidoscarboxilicosporchristiande11a.blogspot.com/p/usos-o-aplicaciones.html
http://usoscompuestosorganicos.blogspot.com/2012/06/acidos-carboxilicos-los-acidos.html
http://html.rincondelvago.com/acidos-carboxilicos_3.html
Con el ácido salicílico forma la aspirina.

Ácido acrílico:
nombre común en química para el ácido propénico, CH2=CH-COOH. Este compuesto orgánico es un líquido incoloro, inflamable, cáustico y de olor punzante, con una temperatura de ebullición de 142 ºC. El ácido acrílico es el ácido carboxílico insaturado más sencillo; sus sales y ésteres se denominan acrilatos. Industrialmente, este ácido se obtiene, entre otros procedimientos, por oxidación catalítica del propeno o por hidrólisis de la acroleína. Debido al doble enlace, el ácido acrílico —al igual que los compuestos derivados del mismo— es muy reactivo. Su reacción principal es la polimerización: los poliacrilatos resultantes son a menudo transparentes pero quebradizos. Para modificar sus propiedades físicas y químicas, pueden combinarse con otros componentes (copolimerización). Así, el ácido acrílico es el material de partida para fabricar plásticos, barnices, resinas elásticas y adhesivos transparentes.
Ácido benzoico:
sólido de fórmula C6H5—COOH, poco soluble en agua y de acidez ligeramente superior a la de los ácidos alifáticos sencillos. Se usa como conservador de alimentos. Es poco tóxico y casi insípido. Se combina con el ácido salicílico en forma de pomada con propiedades antimicóticos. Puede aplicarse sin peligro a la piel.
Ácido fumárico:
Es el ácido trans-butenodioico, compuesto cristalino incoloro, de fórmula HO2CCH=CHCO2H, que sublima a unos 200 °C. Se encuentra en ciertos hongos y en algunas plantas, a diferencia de su isómero cis, el ácido maleico (cis-butenodioico), que no se produce de forma natural.
Es soluble en agua caliente, éter y alcohol. Se obtiene por deshidratación del ácido málico y por isomerización del ácido maleico por distintos procedimientos (acción de la luz, calentamiento...). Interviene en el ciclo de Krebs como intermediario metabólico.
Se utiliza en el procesado y conservación de los alimentos por su potente acción antimicrobiana, y para fabricar pinturas, barnices y resinas sintéticas.

Ácido linoleico:
Líquido oleoso, incoloro o amarillo pálido, de fórmula CH3(CH2)4(CH=CHCH2)2(CH2)6CO2H, cuyos dobles enlaces presentan configuración cis. Es soluble en disolventes orgánicos y se polimeriza con facilidad, lo que le confiere propiedades secantes. El ácido linoleico es un ácido graso esencial, es decir, es un elemento necesario en la dieta de los mamíferos por ser uno de los precursores de las prostaglandinas y otros componentes de tipo hormonal.
Se encuentra como éster de la glicerina en muchos aceites de semillas vegetales, como los de linaza, soja, girasol y algodón. Se utiliza en la fabricación de pinturas y barnices.
Ácido oleico:
líquido oleoso e incoloro, de fórmula CH3(CH2)7CH=CH(CH2)7CO2H en su configuración cis (la cadena de carbono continúa en el mismo lado del doble enlace). Es un ácido graso no saturado que amarillea con rapidez en contacto con el aire. Por hidrogenación del ácido oleico se obtiene el ácido esteárico (saturado). No es soluble en agua, pero sí en benceno, alcohol, éter y otros muchos disolventes orgánicos. Se solidifica por enfriamiento y funde a 14 °C. Su isómero trans (ácido elaídico) es sólido y funde a 51 °C; se puede obtener por calentamiento del ácido oleico en presencia de un catalizador.
Junto con el ácido esteárico y el ácido palmítico se encuentra, en forma de éster, en la mayoría de las grasas y aceites naturales, sobre todo en el aceite de oliva. Se obtiene por hidrólisis del éster y se purifica mediante destilación. Se utiliza en la fabricación de jabones y cosméticos, en la industria textil y en la limpieza de metales.

Ácido salicílico:
sólido blanco y cristalino, que se encuentra en numerosas plantas, en especial en los frutos, en forma de metilsalicilato, y se obtiene comercialmente a partir del fenol. Su fórmula es:
Tiene un sabor ligeramente dulce; es poco soluble en agua y más soluble en alcohol, éter y cloroformo. Tiene un punto de fusión de 159 °C. Este ácido se emplea sobre todo para preparar algunos ésteres y sales importantes. El salicilato de sodio, que se obtiene tratando el fenolato de sodio con dióxido de carbono a presión, se usa para preservar alimentos y en mayor medida para elaborar preparados antisépticos suaves como pasta de dientes y colutorios. Los compuestos salicílicos medicinales empleados como analgésicos y antipiréticos son el ácido acetilsalicílico y el fenilsalicilato, que se venden bajo el nombre comercial de aspirina y salol, respectivamente. El metilsalicilato es el principal componente del aceite de gaulteria o esencia de Wintergreen, y se fabrica sintéticamente en grandes cantidades por reacción de ácido salicílico y metanol.

Ácido caprílico o Ácido undecilénico:
es un líquido amarillo de fórmula CH3(CH2)4COOH, con olor a rancio característico, de actividad fungicida contra diversos hongos. El ácido caprílico y sus sales presentan acción dermatomicótica.

Ácido esteárico:
sólido orgánico blanco de apariencia cristalina, de fórmula CH3(CH2)16COOH. No es soluble en agua, pero sí en alcohol y éter. Junto con los ácidos láurico, mirístico y palmítico, forma un importante grupo de ácidos grasos. Se encuentra en abundancia en la mayoría de los aceites y grasas, animales y vegetales, en forma de éster—triestearato de glicerilo o estearina— y constituye la mayor parte de las grasas de los alimentos y del cuerpo humano. El ácido se obtiene por la hidrólisis del éster, y comercialmente se prepara hidrolizando el sebo. Se utiliza en mezclas lubricantes, materiales resistentes al agua, desecantes de barnices, y en la fabricación de velas de parafina. Combinado con hidróxido de sodio el ácido esteárico forma jabón (estearato de sodio).
El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial.
El ácido esteárico tiene un punto de fusión de 70 °C y un punto de ebullición de 383 °C.

Ácido láctico o Ácido 2-hidroxipropanoico:
Compuesto incoloro de fórmula CH3CHOHCOOH. Se da bajo dos formas ópticamente activas,dextrógira y levógira*, frecuentemente denominadas ácido D-láctico y ácido L-láctico. En su estado natural es una mezcla ópticamente inactiva compuesta por partes iguales de ambas formas D- y L-, conocida como mezcla 'racémica'.
Normalmente se prepara por fermentación bacteriana de lactosa, almidón, azúcar de caña o suero de la leche. Pequeñas cantidades de ácido L-láctico están presentes en la sangre y en otros fluidos y órganos del cuerpo; este ácido se forma en los tejidos, sobre todo los musculares, que obtienen energía metabolizando azúcar en ausencia de oxígeno. La acumulación de grandes cantidades de este ácido en los músculos produce fatiga y puede causar calambres. El ácido láctico que se forma en la leche por la fermentación de la lactosa es el que hace que aquélla se agrie. El ácido láctico se utiliza para elaborar queso, chucrut, col fermentada, bebidas suaves y otros productos alimenticios.

BENEFICIOS Y RIESGOS PARA LA SALUD
Los riesgos específicos de los ácidos inorgánicos más importantes desde el punto de vista industrial se describen más adelante; no obstante, debe decirse que todos estos ácidos poseen ciertas propiedades peligrosas comunes a todos ellos. Las soluciones de ácidos inorgánicos no son inflamables por sí mismas, pero
cuando entran en contacto con ciertos productos químicos o materiales combustibles, se pueden producir incendios o explosiones. Estos ácidos reaccionan con determinados metales liberando hidrógeno, que es una sustancia altamente inflamable y explosiva cuando se mezcla con el aire o con oxígeno. También pueden actuar como agentes oxidantes y, cuando contactan con productos orgánicos u otras sustancias oxidables, pueden reaccionar de forma violenta.
Efectos en la salud. Los ácidos inorgánicos son corrosivos, especialmente cuando se encuentran a altas concentraciones. Pueden destruir los tejidos corporales y producir quemaduras químicas cuando entran en contacto con la piel y las mucosas. Son especialmente peligrosos los accidentes oculares. Los vapores o nieblas de los ácidos inorgánicos irritan el tracto respiratorio y las mucosas, dependiendo el grado de irritación de su concentración; los trabajadores expuestos a estos ácidos pueden sufrir también decoloración o erosiones de los dientes. El contacto repetido con la piel provoca dermatitis. La ingestión accidental de ácidos inorgánicos concentrados causa grave irritación de la garganta y el estómago, así como destrucción tisular de los órganos internos, a veces mortal a no ser que se efectúe inmediatamente el tratamiento de urgencia adecuado. Algunos ácidos inorgánicos actúan también como agentes tóxicos sistémicos.
Los ácidos carboxílico son beneficiosos en distintas áreas como la medicina y la industria. por ejemplo:cuando entran en contacto con ciertos productos químicos o materiales combustibles, se pueden producir incendios o explosiones. Estos ácidos reaccionan con determinados metales liberando hidrógeno, que es una sustancia altamente inflamable y explosiva cuando se mezcla con el aire o con oxígeno. También pueden actuar como agentes oxidantes y, cuando contactan con productos orgánicos u otras sustancias oxidables, pueden reaccionar de forma violenta.
Efectos en la salud. Los ácidos inorgánicos son corrosivos, especialmente cuando se encuentran a altas concentraciones. Pueden destruir los tejidos corporales y producir quemaduras químicas cuando entran en contacto con la piel y las mucosas. Son especialmente peligrosos los accidentes oculares. Los vapores o nieblas de los ácidos inorgánicos irritan el tracto respiratorio y las mucosas, dependiendo el grado de irritación de su concentración; los trabajadores expuestos a estos ácidos pueden sufrir también decoloración o erosiones de los dientes. El contacto repetido con la piel provoca dermatitis. La ingestión accidental de ácidos inorgánicos concentrados causa grave irritación de la garganta y el estómago, así como destrucción tisular de los órganos internos, a veces mortal a no ser que se efectúe inmediatamente el tratamiento de urgencia adecuado. Algunos ácidos inorgánicos actúan también como agentes tóxicos sistémicos.
El acido acético, se emplea como disolvente y en la fabricación en una gran variedad de productos químicos orgánico: plásticos, gomas, drogas, entre otras. también se utiliza en la industria del cultito de colorantes.
El acido cítrico, que provee el sabor agrio a los frutos cítrico, es un importante intermediario del metabolismo de los carbohidratos, y se emplea comercialmente en grandes cantidades como acidificante de bebidas refrescante.
El acido butanoico (butírico), presente en la mantequilla, se emplea para fabricar perfumes sintéticos, saborizantes y aditivos alimenticios.
La aspirina también es un acido carboxílico (acido acetilsatisilirico) su popularidad se debe a sus propiedades analgésicas, antipirereticas y antifamatorias, se utilizan, además, como drogas anticoagulante, para prevenir la formación de coágulos sanguíneos.
NOMENCLATURA
La IUPAC nombra los ácidos carboxílicos reemplazando la terminación -ano del alcano con igual número de carbonos por -oico.

Cuando el ácido tiene sustituyentes, se numera la cadena de mayor longitud dando el localizador más bajo al carbono del grupo ácido. Los ácidos carboxílicos son prioritarios frente a otros grupos, que pasan a nombrarse como sustituyentes.

Los ácidos carboxílicos también son prioritarios frente a alquenos y alquinos. Moléculas con dos grupos ácido se nombran con la terminación -dioico.

Cuando el grupo ácido va unido a un anillo, se toma el ciclo como cadena principal y se termina en
-carboxílico.


Cuando el ácido tiene sustituyentes, se numera la cadena de mayor longitud dando el localizador más bajo al carbono del grupo ácido. Los ácidos carboxílicos son prioritarios frente a otros grupos, que pasan a nombrarse como sustituyentes.

Los ácidos carboxílicos también son prioritarios frente a alquenos y alquinos. Moléculas con dos grupos ácido se nombran con la terminación -dioico.

Cuando el grupo ácido va unido a un anillo, se toma el ciclo como cadena principal y se termina en
-carboxílico.

BIBLIOGRAFIA
http://profesionseg.blogspot.com/2007/05/riesgos-de-los-acidos-inorganicos.html
http://www.slidefinder.net/i/iod%C3%B3foros/32438139/p2
http://acidoscarboxilicosporchristiande11a.blogspot.com/p/usos-o-aplicaciones.html
http://usoscompuestosorganicos.blogspot.com/2012/06/acidos-carboxilicos-los-acidos.html
http://html.rincondelvago.com/acidos-carboxilicos_3.html
 R-COO- + H+
R-COO- + H+