Creado por : Laura Andrea Carreño Ribero
Grado: 11-2T
Alcoholes

En química se denomina alcohol a aquellos compuestos químicos orgánicos que
contienen un grupo hidroxilo (-OH)
en sustitución de un átomo de hidrógeno enlazado
de forma covalente a
un átomo de carbono. Además, este carbono debe estar saturado, es decir, debe
tener solo enlaces simples a sendos átomos, esto diferencia a los alcoholes de los fenoles.
Propiedades Físicas De Los Alcoholes :
Las propiedades físicas
de un alcohol se basan principalmente en su estructura. El alcohol esta
compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por
el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con
afinidad por el agua), similar al agua. De estas dos unidades estructurales, el
grupo –OH da a los alcoholes sus propiedades físicas características, y el
alquilo es el que las modifica, dependiendo de su tamaño y forma.El
grupo –OH es muy polar y, lo que es más importante, es capaz de establecer
puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas
neutras.
Solubilidad:
Puentes de hidrógeno:
La formación de puentes de
hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de
hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes
forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad
del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
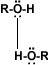
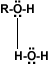
A partir de 4 carbonos en
la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque
el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en
comparación con la porción hidrocarburo. A partir del hexanol son solubles
solamente en solventes orgánicos.
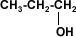
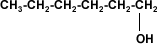
Existen alcoholes de cuatro átomos de carbono que son solubles en
agua, debido a la disposición espacial de la molécula. Se trata de moléculas
simétricas.
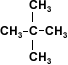
Existen alcoholes con
múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para
formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
Punto De Ebullición:
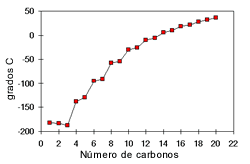
Los puntos de ebullición
de los alcoholes también son influenciados por la polaridad del compuesto y la
cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen
que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo
peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad
de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
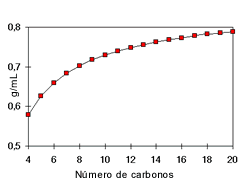
Densidad:
La densidad de los
alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que
los alcoholes alifáticos son menos densos que el agua mientras que los
alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH,
denominados polioles, son más densos.
(Constantes Físicas de algunos alcoholes)
| Nombre | Punto de fusiónºC | Punto de ebullición ºC | Densidad |
| Metanol | -97,5 | 64,5 | 0,793 |
| 1-propanol | -126 | 97,8 | 0,804 |
| 2-propanol | -86 | 82,3 | 0,789 |
| 1-butanol | -90 | 117 | 0,810 |
| 2-butanol | -114 | 99,5 | 0,806 |
| 2-metil-1-propanol | -108 | 107,3 | 0,802 |
| 2-metil-2-propanol | 25,5 | 82,8 | 0,789 |
| 1-pentanol | -78,5 | 138 | 0,817 |
| Ciclohexanol | 24 | 161,5 | 0,962 |
Propiedades Químicas De Los Alcoholes:
Los alcoholes pueden
comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es
más que el efecto que ejerce la molécula de –OH como sustituyente sobre los
carbonos adyacentes. Gracias a este efecto se establece un dipolo.
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.
| Alcohol Terciario | 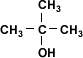 | 2-metil-2-propanol |
| Alcohol Secundario | 2-butanol | |
| Alcohol Primario | 1-butanol | |
| Metanol |
Metanol > alcohol primario > alcohol
secundario > alcohol terciario(>: mayor acidez)
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
Deshidratación:
la deshidratación de los
alcoholes se considera una reacción de eliminación, donde el alcohol pierde su
grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter
básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor.
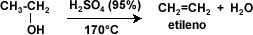
La deshidratación es
posible ya que el alcohol acepta un protón del ácido, para formar el alcohol
protonado o ión alquil hidronio.
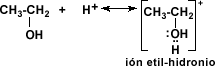
El alcohol protonado
pierde una molécula de agua y forma un ión alquil-carbonio
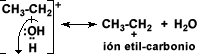
El ión alquil-carbonio
pierde un protón lo que regenera la molécula de ácido sulfúrico y se establece
el doble enlace de la molécula a la cual está dando origen el alcohol.
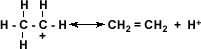
El calentamiento de un alcohol en presencia de ácido sulfúrico a
temperaturas inferiores a las necesarias para obtener alquenos producirá otros
compuestos como éteres y ésteres.
Obtencion De Los Alcoholes:
Al igual que a partir de los alcoholes se pueden obtener otros
compuestos, los alcoholes pueden ser obtenidos a partir de hidratación o
hidroboración – oxidación de alquenos, o mediante hidrólisis de halogenuros de
alquilo. Para la obtención de alcoholes por hidratación de alquenos
se utiliza el ácido sulfúrico y el calor.
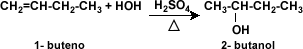
La
Hidroboración:
(Adición de borano R3B) de alqueno en presencia de peróxido de
hidrógeno (H2O2) en medio alcalino da origen a un alcohol.
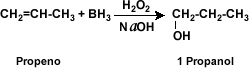
La Hidrólisis:
De halogenuros de
alquilo o aralquilo se produce en presencia de agua y hidróxidos fuertes que
reaccionan para formar alcoholes.
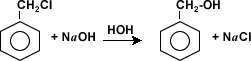
En la industria la
producción de alcoholes se realiza a través de diversas reacciones como las ya
mencionadas, sin embargo se busca que éstas sean rentables para proporcionar la
máxima cantidad de producto al menor costo. Entre las técnicas utilizadas por
la industria para la producción de alcoholes se encuentra la fermentación donde
la producción de ácido butírico a partir de compuestos azucarados por acción de
bacterias como el Clostridium butycum dan origen al butanol e isopropanol. Para
la producción de alcoholes superiores en la industria la fermentación permite
la producción de alcoholes isoamílico, isobutílico y n-propílico a partir de
aminoácidos. Es así como la industria utiliza los procesos metabólicos de
ciertas bacterias para producir alcoholes.
Utilidades EN LA INDUSTRIA Y LA VIDA DIARIA
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles.
Debido a sus debilidad como tensioactivos, no se emplean como tales si no es en presencia de otro surfactante de mejores propiedades.
Por tanto, su principal uso es como estabilizantes de emulsiones, opacificantes, espesantes o espumantes, según la concentración.
Se pueden obtener diversos alcoholes como subproductos de procesos de síntesis de otros
compuestos orgánicos.
Los tres alcoholes que encontramos con más frecuencia en la vida diaria son metanol, etanol y 2-propanol. Todos ellos son precursores de otras sustancias químicas, tienen usos variados y se producen en grandes cantidades.
El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla.

El metanol o alcohol de madera, se produce durante la obtención de licor en alambiques clandestinos, los cuales no garantizan una temperatura estable a lo largo del proceso de destilación, generando así un licor contaminado (mezcla de etanol y metanol), que en última instancia va al consumidor. Es de anotar que esta mezcla tóxica también puede llegar a obtenerse en la producción de bebidas alcohólicas caseras como la chicha. Antiguamente además se obtenía de la destilación en seco de la madera; pero hoy se obtiene a nivel industrial como un subproducto de la producción de polímeros y se utiliza como removedor de pinturas, limpia brisas, anticongelante, tinner, lacas, barnices, productos fotográficos, solventes, además como materia prima para manufactura de plásticos, textiles, secantes, explosivos, caucho, entre otros productos.

Beneficios Y Riesgos Para La Salud
Se dice que los excesos de las cosas buenas son malos, y en el caso del alcohol, es especialmente cierto.
Beber demasiado alcohol causa una larga lista de serios problemas de salud, incluyendo infartos, diversos cánceres y ataques al corazón, así como el alcoholismo, que es una enfermedad en sí misma.
Por otro lado, cualquier estudio sobre el alcohol ha demostrado que su consumo moderado tiene efectos beneficiosos para la salud.
Investigaciones llevadas a cabo en el año 1999 demuestran que el consumo moderado de alcohol (básicamente de vino tinto) disminuye el riesgo de embolia, pero consumir elevadas cantidades de alcohol aumenta el riesgo de ataques.

El crecimiento del alcohol combustible se debe a sus múltiples beneficios, entre los que destacan los siguientes:
- Es un producto agroindustrial 100% nacional.
- Genera empleos directos e indirectos.
- Fomenta la actividad agrícola e incentiva la generación de empleo productivo.
- Genera inversiones.
- Es renovable y amigable con el medio ambiente.
- Permite sustituir un combustible fósil e importado por uno renovable y producido localmente.
- Tiene el potencial de reemplazar al menos el 10% del consumo nacional de gasolina.
- Reduce la dependencia en el petróleo importado.
- Conlleva a un ahorro de divisas debido a la reducción de las importaciones de petróleo.
- Es el único combustible renovable automotor disponible a escala comercial.
- Puede estabilizar el precio de la gasolina y/o diesel.
- Conlleva a un incremento en la generación de energía a partir de biomasa.
Bibliografia:
Ésteres
Son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1
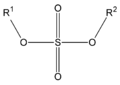
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster
(éster de ácido carboxílico)
| Éster carbónico
(éster de ácido carbónico)
| Éster fosfórico
(triéster de ácido fosfórico)
| Éster sulfúrico
(diéster de ácido sulfúrico)
|
|---|---|---|---|
 |  |  |  |
Propiedades Físicas:
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
- Acetato de 2 Etil Hexilo: olor a dulzón suave
- butanoato de metilo: olor a Piña
- salicilato de metilo (aceite de siempreverde o menta): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
- octanoato de heptilo: olor a frambuesa
- etanoato de isopentilo: olor a plátano
- pentanoato de pentilo: olor a manzana
- butanoato de pentilo: olor a pera o a albaricoque
- etanoato de octilo: olor a naranja.
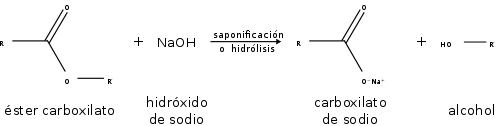
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
Propiedades Químicas :
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.2 La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3 reflujado con THF.3
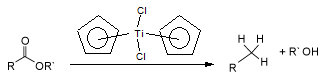
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.4 El mecanismo probablemente se debe a la formación de un alqueno intermediario.
El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como la condensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchos métodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
Usos de los esteres :
Muchos ésteres tienen un olor característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
* Metil butanoato: olor a piña
* Metil butanoato: olor a piña

* Metil salicilato (aceite de siempreverde): olor de las pomadas Germolene y Ralgex (Reino Unido)

* Etil metanoato: olor a frambuesa

* Pentil etanoato: olor a plátano
* Pentil pentanoato: olor a manzana
* Pentil butanoato: olor a pera o a albaricoque
* Octil etanoato: olor a naranja
.
Beneficios Y Riesgos Para La Salud
La
importancia de los ácidos carboxílicos radica en que, son compuestos base de
una gran variedad de derivados, entre los cuales se encuentran a los ésteres,
amidas, cloruros de acilo y anhídridos de ácido. Están presentes también en
algunos alimentos saturados e insaturados, como por ejemplo la mantequilla o la
leche.
Los
ácidos carboxílicos son compuestos de gran importancia para el hombre, ya que,
además de estar presentes en los alimentos que contienen las proteínas
desdobladas por el cuerpo humano para aprovechar su energía, están presentes en
procesos fundamentales del organismo, como lo es, por ejemplo, el ciclo de
Krebs, esto se debe a que los ácidos carboxílicos forman parte de todos los
ácidos participantes en este proceso, como por ejemplo el ácido fumárico;
además de ser parte de algunas moléculas importantes para el organismo, tales
como los aminoácidos, los cuales son participantes en la síntesis de proteínas
del cuerpo.Estos ácidos son también componentes de muchas de las células del
cuerpo, esto es porque los ácidos carboxílicos constituyen a los fosfolípidos y
los triacilglicéridos, los cuales son ácidos grasos que se encuentran en las
membranas celulares, en las neuronas, en las células del músculo cardíaco, y
además, en las células del tejido nervioso.
Nomenclatura De Los Esteres:
Los ésteres reciben nombres como si fueran sales inorgánicas.
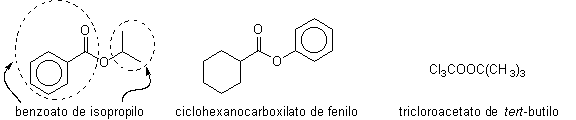
Los ésteres son compuestos orgánicos constituidos a base de un grupo acilo (derivado de un oxoácido) R-CO- y un grupo alquilo -R, unidos por un átomo de oxígeno O.
La fórmula general, por lo tanto, es: R-CO O-R
R-CO es el grupo acilo y -R es el grupo alquilo (metil, etil, propil, etc.)
El nombre de los ésteres se deriva de los ácidos carboxílicos y está formado por:
1. la primera palabra se deriva del ácido carboxílico; se elimina la palabra ácido y se cambia la terminación ico por la de ato.
2. la segunda palabra corresponde al nombre del grupo alquilo unido al oxígeno y precedido de la preposición "de".
3. Ejemplos: propanoato de metilo, etanoato de metilo .
R-CO es el grupo acilo y -R es el grupo alquilo (metil, etil, propil, etc.)
El nombre de los ésteres se deriva de los ácidos carboxílicos y está formado por:
1. la primera palabra se deriva del ácido carboxílico; se elimina la palabra ácido y se cambia la terminación ico por la de ato.
2. la segunda palabra corresponde al nombre del grupo alquilo unido al oxígeno y precedido de la preposición "de".
3. Ejemplos: propanoato de metilo, etanoato de metilo .
4. En caso de que exista un núcleo bencénico en la fórmula unido al -CO O-R, lo único que hacemos es escribir el nombre: benzoato y luego el nombre del grupo alquilo (metil, etil, etc.)
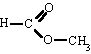 |
Metanoato de metilo
(Formiato de metilo) | 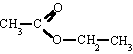 |
Etanoato de etilo
(Acetato de etilo) |
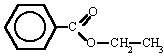 |
Benzoato de etilo
| 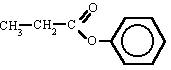 |
Propanoato de fenilo
|
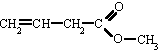 |
3-butenoato de metilo
| 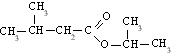 |
Isopentiloato de isopropilo
|
Esteres en la industria
- Medio de arrastre para la deshidratacion de alcoholes isopropilicos y etílicos.
- Disolvente de sustacias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores diésel.
- Fuertes pegamentos.
- Antinflamatorio abdominal para después del parto, solo uso externo.
- Anestésicos.
Bibliografia :
Éteres
En química orgánica y bioquímica, un éter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, estando el átomo de oxígeno unido y se emplean pasos intermedios:
- ROH + HOR' → ROR' + H2O
Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH.
- RO- + R'X → ROR' + X-
Al igual que los ésteres, no forman puentes de hidrógeno. Presentan una alta hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser utilizados como disolventes orgánicos.
Suelen ser bastante estables, no reaccionan fácilmente, y es difícil que se rompa el enlace carbono-oxígeno. Normalmente se emplea, para romperlo, un ácido fuerte como el ácido yodhídrico, calentando, obteniéndose dos halogenuros, o un alcohol y un halogenuro. Una excepción son los oxiranos (o epóxidos), en donde el éter forma parte de un ciclo de tres átomos, muy tensionado, por lo que reacciona fácilmente de distintas formas.
El enlace entre el átomo de oxígeno y los dos carbonos se forma a partir de los correspondientes orbitales híbridos sp³. En el átomo de oxígeno quedan dos pares deelectrones no enlazantes.
Propiedades Físicas:
- Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
![[small][AnimePaper]wallpapers_Ergo-Proxy_Tenken-the-2nd(1_33)__THISRES__73653 [small][AnimePaper]wallpapers_Ergo-Proxy_Tenken-the-2nd(1_33)__THISRES__73653](http://kira2629.files.wordpress.com/2009/06/smallanimepaperwallpapers_ergo-proxy_tenken-the-2nd1_33__thisres__73653.jpg?w=477&h=86)
- La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclo propano.
Cuclo propano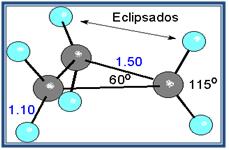

Epóxido de etileno
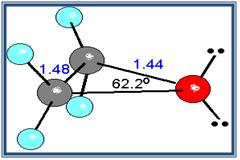
- Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
Propiedades Químicas:
- Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
- En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
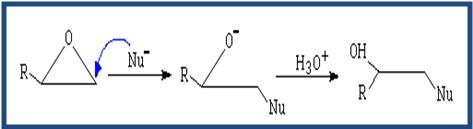
- Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
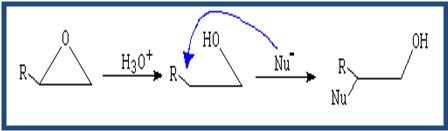
(Apertura catalizada por ácido) El nucleófilo ataca al carbono más sustituido.
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
¿Qué posibilidades hay de que los PBDEs produzcan cáncer?
No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales.
¿Cómo pueden los PBDEs afectar a los niños?
Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan.La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos.
Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan.La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos.
Estructura Qumica:
Los eteres se obtienen de la deshidratación de dos moléculas de alcohol
Ejemplo:
CH3OH + CH3OH --> CH3-O-CH3 + H20
Metanol + Metano -->Metil-oxi-metil o Metano-oxi-metano o Eter metil metílico
CH3CH2OH + CH3CH2CH2OH --> CH3CH2-O-CH2CH2CH3 + H2O
Etanol + Propanol --> Etil-oxi-propil o Etano-oxi-propano o Eter etil propílico.
Son las diferentes nomenclaturas que pueden tomar los éteres.
Ejemplo:
CH3OH + CH3OH --> CH3-O-CH3 + H20
Metanol + Metano -->Metil-oxi-metil o Metano-oxi-metano o Eter metil metílico
CH3CH2OH + CH3CH2CH2OH --> CH3CH2-O-CH2CH2CH3 + H2O
Etanol + Propanol --> Etil-oxi-propil o Etano-oxi-propano o Eter etil propílico.
Son las diferentes nomenclaturas que pueden tomar los éteres.
- Se nombran interponiendo la partícula "-oxi-" entre los dos radicales. Se considera el compuesto como derivado del radical más complejo, así diremos metoxietano, y no etoximetano.
| metoxietano |
- También podemos nombrar los dos radicales, por orden alfabético, seguidos de la palabra "éter".
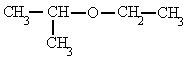 |
| etil isopropil éter |
En éteres complejos podemos emplear otros métodos:
- Si los grupos unidos al oxígeno son iguales y poseen una función preferente sobre la éter, después de los localizadores de la función éter se pone la partícula oxi- y el nombre de los grupos principales.
| 3,3'-oxidipropan-1-ol |
- Si aparecen varios grupos éter se nombran como si cada uno substituyera a un CH2 a través de la partícula -oxa-.
| 3,6-dioxaheptan-1-ol |
- Si un grupo éter está unido a dos carbonos contiguos de un hidrocarburo se nombran con la partícula epoxi-.
| 2,3-epoxibutano |
Bibliografia:
No hay comentarios:
Publicar un comentario