Creado Por: Nahid Daniela Vera Chinchilla
Grado: 11-2T
ALOHOLES
Compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrogeno enlazado de forma covalente a un átomo de carbono. Además, este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos, esto diferencia a los alcoholes de los fenoles.
Si contienen varios grupos hidroxilos se denominan polialcoholes. Los alcoholes pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.
Propiedades Químicas De Los Alcoholes
Los alcoholes pueden comportarse como ácidos o bases gracias a que el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que presenta la molécula de agua.
OXIDACIÓN :
La oxidación es la reacción de alcoholes para producir ácidos carboxilicos, cetonas o aldehídos dependiendo de el tipo de alcohol y de catalizador, puede ser:
- La reacción de un alcohol primario con ácido crómico (CrO3) en presencia de piridina produce un aldehído:
- La reacción de un alcohol primario en presencia del reactivo de Jones produce un ácido carboxilo:
- La reacción de un alcohol secundario en presencia de permanganato de potasio produce una cetona:
DESHIDROGENACIÓN:
Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
El alcohol reacciona con el ácido hidrácido para formar haluros de alquilo mas agua:
R-OH + HX -------------------) R-X + H2O
DESHIDRATACIÓN:
Es una propiedad de los alcoholes mediante la cual podemos obtener éteres o alquenos:
2 R -CH2OH ----------------) R - CH2 - O - CH2 - R'
R-R-OH ------------) R=R + H2O
REACCIÓN CON CLORURO DE TIONILO:
El cloruro de tionilo (SOCl2) se puede usar para convertir alcoholes en el correspondiente cloruro de alquilo en una reacción simple que produce HCl gaseoso y SO2.
Propiedades Físicas De Los Alcoholes
Las propiedades físicas de los alcoholes estan relacionados con el grupo -OH, que es muy porlar y es capaz de establacer puentes de hidrógeno con sus moéculas compañeras, con otras moléculas neutras, y con aniones.
Esto hace que el punto de ebullición de los alcholes sea mucho m;ás elevado que los de otros hidrocarburos con igual peso molescular.
El comportamiento de los alcoholes con respecto a su solubilidad también refleja su tendencia a formar puentes de hidrógeno. Así, los alcoholes inferiores, son miscibles en el agua, mientras que esta propiedad va perdiéndose a medida que el grupo lipófilo va creciendo, pues el grupo -OH deja de ser una parte considerable de la molécula.
 | Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma. | |||||||||||||||||||||||||||||||||||||||||||
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
| ||||||||||||||||||||||||||||||||||||||||||||
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
| ||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
| ||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||
| Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas. | |||||||||||||||||||||||||||||||||||||||||||
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
|
| |||||||||||||||||||||||||||||||||||||||||||
|
Punto de Ebullición:
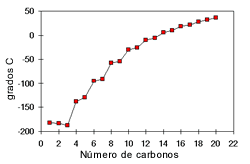
Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
| |||||||||||||||||||||||||||||||||||||||||||
| El punto de fusión aumenta a medida que aumenta la cantidad de carbonos. |
| |||||||||||||||||||||||||||||||||||||||||||
Densidad:
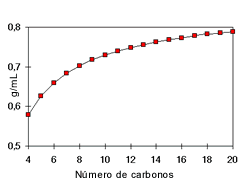
La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos.
(Constantes Físicas de algunos alcoholes)
| ||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
Utilidades En La Industria Y En La Vida Diaria De Los Alcoholes
En la industria la producción de alcoholes se realiza a través de diversas reacciones como las ya mencionadas, sin embargo se busca que éstas sean rentables para proporcionar la máxima cantidad de producto al menor costo. Entre las técnicas utilizadas por la industria para la producción de alcoholes se encuentra la fermentación donde la producción de ácido butírico a partir de compuestos azucarados por acción de bacterias como el Clostridium butycum dan origen al butanol e isopropanol. Para la producción de alcoholes superiores en la industria la fermentación permite la producción de alcoholes isoamílico, isobutílico y n-propílico a partir de aminoácidos. Es así como la industria utiliza los procesos metabólicos de ciertas bacterias para producir alcoholes.

El etanol:
Puede utilizarse como combustible para automóviles por sí mismo o también puede mezclarse con gasolina en cantidades variables para reducir el consumo de derivados del petróleo. El combustible resultante se conoce como gasohol (en algunos países, "alconafta"). Dos mezclas comunes son E10 y E85, que contienen el etanol al 10% y al 85%, respectivamente.
El etanol también se utiliza cada vez más como añadido para oxigenar la gasolina estándar, como reemplazo para el metil terc-butil éter. Este último es responsable de una considerable contaminación del suelo y del agua subterránea. También puede utilizarse como combustible en las celdas de combustible.
El etanol que proviene de los campos de cosechas (bioetanol) se perfila como un recurso energético potencialmente sostenible que puede ofrecer ventajas medioambientales y económicas a largo plazo en contraposición a los combustibles fósiles. Se obtiene fácilmente del azúcar o del almidón en cosechas de maíz y caña de azúcar, por ejemplo. Sin embargo, los actuales métodos de producción de bio-etanol utilizan una cantidad significativa de energía comparada al valor de la energía del combustible producido. Por esta razón, no es factible sustituir enteramente el consumo actual de combustibles fósiles por bio-etanol.
El etanol también se utiliza cada vez más como añadido para oxigenar la gasolina estándar, como reemplazo para el metil terc-butil éter. Este último es responsable de una considerable contaminación del suelo y del agua subterránea. También puede utilizarse como combustible en las celdas de combustible.
El etanol que proviene de los campos de cosechas (bioetanol) se perfila como un recurso energético potencialmente sostenible que puede ofrecer ventajas medioambientales y económicas a largo plazo en contraposición a los combustibles fósiles. Se obtiene fácilmente del azúcar o del almidón en cosechas de maíz y caña de azúcar, por ejemplo. Sin embargo, los actuales métodos de producción de bio-etanol utilizan una cantidad significativa de energía comparada al valor de la energía del combustible producido. Por esta razón, no es factible sustituir enteramente el consumo actual de combustibles fósiles por bio-etanol.

El metanol:
El metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de b aja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible ( esto ultimo es lo que nos interesa ) .
Genera menor contaminación ambiental que los combustibles fósiles. no lo probe pero debe dar un ayudin para pasar la vtverga
La Asociación de Recursos Renovables de Canadá señala que agregar un 10 por ciento de etanol al combustible reduciría hasta en un 30 por ciento las emisiones de monóxido de carbono (CO) y entre 6 y 10 por ciento las de dióxido de carbono (CO2); asimismo habría una reducción en la formación de ozono.
Genera menor contaminación ambiental que los combustibles fósiles. no lo probe pero debe dar un ayudin para pasar la vtverga
La Asociación de Recursos Renovables de Canadá señala que agregar un 10 por ciento de etanol al combustible reduciría hasta en un 30 por ciento las emisiones de monóxido de carbono (CO) y entre 6 y 10 por ciento las de dióxido de carbono (CO2); asimismo habría una reducción en la formación de ozono.
En concentraciones elevadas el metanol puede causar dolor de cabeza, mareo, náuseas, vómitos y muerte (la ingestión de 20ml a 150ml se trata de una dosis mortal2 ). Una exposición aguda puede causar ceguera o pérdida de la visión, ya que puede dañar seriamente el nervio óptico (neuropatía óptica). Una exposición crónica puede ser causa de daños al hígado o de cirrosis. El metanol, a pesar de su toxicidad, es muy importante en la fabricación de medicinas. asi que no pasa nada. Tiene numerosos usos como tintas y edulcorantes ( que no viene al caso explicar ya que lo que interesa es el POWER en el motor ).
El butanol:
Es un alcohol del cuatro-carbono. tiene dos posible químico las estructuras, dependiendo de la posición del hidróxilo,: El N butanol ([CH.sub.3] [CH.sub.2] [CH.sub.2][CH.sub.2]OH) y 2 butanol ([CH.sub.3] [OH.sub.1] [CH.sub.2] [CH.sub.3]) la Fermentación de azucares . produce butanol. NO etanol Diferente o metanol, el butanol puede sustituya para o se mezcle con el combustible del diesel en la condensación la ignición engines. de que se produce por la fermentación bacteriana el almidón - o azúcar-conteniendo el feedstocks y purificó por la destilación.
Las bacterias producen etanol y acetona además del
el producto principal, el butanol.
La producción de butanol tiene dos desventajas: (1) la fermentación de butanol es difícil comparado con eso de etanol; y (2) la fermentación del butanol produce el combustible menos-útil por la unidad de el feedstock que la fermentación del etanol con la levadura. El Butanol de ha sido producido comercialmente bajo las condiciones de tiempo de guerra. Today, sin embargo, el butanol ya no se produce comercialmente para el uso como el combustible.
Las bacterias producen etanol y acetona además del
el producto principal, el butanol.
La producción de butanol tiene dos desventajas: (1) la fermentación de butanol es difícil comparado con eso de etanol; y (2) la fermentación del butanol produce el combustible menos-útil por la unidad de el feedstock que la fermentación del etanol con la levadura. El Butanol de ha sido producido comercialmente bajo las condiciones de tiempo de guerra. Today, sin embargo, el butanol ya no se produce comercialmente para el uso como el combustible.

El Propanol:
Tambien llamado alcohol isopropìlico, se utiliza como alcohol de frotamiento. Los alcoholes de frotamiento ayudan a disminuir la temperatura del cuerpo de una persona que tiene fiebre. Sin embargo, algunas evidencias indican que la frotación con alcohol posiblemente prolonga la fiebre e interfiere con la respuesta natural del cuerpo hacia una infección. Además, el alcohol isopropìlico también se utiliza como agente antiséptico. Con frecuencia se frota en la piel antes de una inyección para matar los organismos que puedan introducirse en una punzada. El alcohol isopropilico es casi dos veces más toxico que el etanol, sin embargo, se presentan pocas muertes por ingestión de alcohol isopropìlico debido a que es difícil mantenerlo en el organismo.

Beneficios Y Riesgos Para La Salud De Los Alcoholes
El alcohol etílico es la sustancia psicoactiva de mayor consumo en el mundo y en Colombia. De acuerdo con el informe mundial sobre el consumo de drogas de la ONU de 2004, se estima que en el mundo cerca de 2.600 millones de personas lo consumen ya sea en forma ocasional, habitual, abusiva o adictiva. En Colombia, el programa presidencial RUMBOS estimó en 2001, que el 89.7% de los estudiantes universitarios eran consumidores habituales de alcohol etílico. Esta sustancia también es la más utilizada en Colombia como sustancia de inicio para el consumo habitual de otras sustancias psicoactivas.
El etanol cuando se consume en forma continuada y frecuente produce efectos adversos agudos y crónicos en la salud humana. En consumidores crónicos de alcohol, se han comprobado efectos adversos nutricionales, neurológicos, hepáticos y teratogénicos. En intoxicación aguda se pueden presentar alteraciones en el sistema nervioso central, gastrointestinal, endocrino y en el equilibrio ácido básico especialmente.
El consumo de etanol también se ha asociado con la presentación de varias alteraciones sociales como incremento en los índices de violencia intrafamiliar, violencia general, actos delictivos y accidentes de tránsito.
Sus altos índices de consumo, su comprobado efecto tóxico sobre la salud, sus repercusiones negativas sobre los roles sociales del individuo, unidos al hecho de ser una sustancia legal y socialmente aceptada, señalan el consumo incontrolado de bebidas alcohólicas como un verdadero problema de salud pública, sobre el cual es necesario llamar la atención.
El etanol cuando se consume en forma continuada y frecuente produce efectos adversos agudos y crónicos en la salud humana. En consumidores crónicos de alcohol, se han comprobado efectos adversos nutricionales, neurológicos, hepáticos y teratogénicos. En intoxicación aguda se pueden presentar alteraciones en el sistema nervioso central, gastrointestinal, endocrino y en el equilibrio ácido básico especialmente.
El consumo de etanol también se ha asociado con la presentación de varias alteraciones sociales como incremento en los índices de violencia intrafamiliar, violencia general, actos delictivos y accidentes de tránsito.
Sus altos índices de consumo, su comprobado efecto tóxico sobre la salud, sus repercusiones negativas sobre los roles sociales del individuo, unidos al hecho de ser una sustancia legal y socialmente aceptada, señalan el consumo incontrolado de bebidas alcohólicas como un verdadero problema de salud pública, sobre el cual es necesario llamar la atención.
El alcohol se absorbe en estómago (un 20% en ayuno) y el máximo en sangre aparece a los 40-45 minutos. La comida retarda la absorción en el tubo digestivo. El alcohol tarda de 10-30 horas en desaparecer de la sangre.
El metabolismo es:
Alcohol alcohol deshidrogenasas acetaldehído.
Acetaldehído alcohol deshidrogenasa ácido acético.
La sintomatología a dosis elevadas y repetidas es de hepatotóxico y neurotóxico potente.
1. Sedación, distensión psíquica.
2. Euforia.
3. Alteración de la sensación dolorosa.
4. Alteración de la coordinación muscular.
5. Narcosis.
6. Hiperventilación.
7. Sensación de angustia.
8. Pérdida de reflejos.
9. Parálisis de la respiración y muerte muy difícil porque provoca vómito.
El etanol es uno de los productos que más contraindicaciones tiene.
METANOL
Es alcohol de quemar. Suele ser azul por el colorante que le añaden.
Es más tóxico en humanos y primates que en otras especies animales. Se han reportado también casos letales por exposición dérmica e inhalatoria.
El MeOH es oxidado en el hígado a formaldehído (por la alcohol deshidrogenasa en primates y catalasa peroxidasa en roedores). Después pasa a ácido fórmico (por la formaldehído deshidrogenasa) en mamíferos no primates. El ácido fórmico pasa a CO2 y H2O.
En humanos, la ingestión de 0'15 ml / kg de metanol puro puede causar una intoxicación borrachera, acidosis metabólica a las 8-12 horas y posible ceguera temporal o permanente.
Se debe hacer emesis, lavado gástrico, carbón activo y corrección de la acidosis para evitar que continúe.
Actuando la alcohol deshidrogenasa se da etanol, 4-metilpirazol (inhibidor de la alcohol deshidrogenasa).
Antes se usaba para ayudar a llegar a cierto grado de alcohol en bebidas.
ETILENGLICOL
Su mecanismo de acción consiste en la formación de ácidos oxálicos que se combinan con Ca2+ y cristaliza en capilares y túbulos renales.
La sintomatología tiene dos fases. La primera fase produce vómitos, depresión nerviosa, ataxia, taquipnea, hipotermia y acidosis.
La segunda fase produce una insuficiencia renal.
Los cristales son birrefringentes y se puede detectar por eso.
El tratamiento consiste en un lavado gástrico, carbón activo, catártico salino, pentobarbital sódico, prednisona, bicarbonato de sodio IV, etanol (no siempre recomendable), 4-metilpirazol (antídoto de elección).
DISOLVENTES Y SUSTANCIAS AFINES
Productos usados preferentemente como disolventes o como diluyentes, pero también como compuestos de partida para la síntesis de otros productos combustibles, anticoagulantes, aromatizantes, bebidas, fármacos...
- Hidrocarburos alifáticos pentano, hexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente), heptano, octano, etilén, acetileno...
- Hidrocarburos alicíclicos ciclopropano, ciclohexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente)...
- Hidrocarburos aromáticos benceno (anillo principal aromático, es carcinógeno, lo lleva más la gasolina sin plomo), tolueno, xileno...
- Hidrocarburos halogenados cloroformo, tricloroetileno, tetracloruro de C (disolvente de productos en seco), halotano, enfluorane (muy buenos disolventes pero muy problemáticos).
- Cetonas acetona.
- Éter éter dietílico (buen disolvente y anestésico). Muy explosivo. Punto de ebullición de 35ºC.
- Alcoholes metanol, etanol, n-propanol, isopropanol, etilenglicol, fenol...
- Aldehídos formaldehído, acetaldehído...
- Nitrilos acetonitrilo...
ALQUITRÁN
Muy variable. 50% betún y 50% otros compuestos como el benceno, tolueno, xilenos, naftalenos, fenoles, cresoles y amoniacos.
Les gusta mucho a los cerdos. También a los gatos (muy susceptible para la glucoronoconjugación).
La sintomatología que produce es anorexia, depresión, debilidad, ictericia, taquipnea y muerte.
Los esnifadores de cola usaban el benceno y, ahora, el tolueno.
FENOLES Y CRESOLES
Usados como desinfectantes, ungüentos, preservación de la madera (palos de electricidad y teléfonos, traviesas de la vía...).
Afecta a gatos principalmente.
La sintomatología es depresión, vómitos, incoordinación, convulsiones, coma y muerte.
El tratamiento consiste en emesis o lavado gástrico, glucosa salina IV, estimulantes del sistema nervioso...
Tiene mal pronóstico.
HIDROCARBUROS AROMÁTICOS POLICÍCLICOS
Sobre todo se forman en la combustión de materia orgánica, volcanes, incendios forestales, alimentos ahumados o alimentos sometidos a altas temperaturas, motores de combustión interna, tabaco (sobre todo benzopireno).
Necesitan la activación metabólica.
Son carcinógenos.
No es recomendable basar la dieta en estos productos.
DAÑOS AL CUERPO
- Inhalación: Altas concentraciones de vapores de metanol pueden causar la muerte.
El primer síntoma de envenenamiento con Metanol es la ceguera ya que daña el nervio óptico.
El Etanol, es la droga más antigua usada por el hombre, es una de las drogas que provoca mas dependencia afectando principalmente al hígado. El Alcohólico sufre una variación biológica cualitativa de la respuesta del sistema nervioso.
- Sistema Digestivo: Irrita la mucosa del esófago, el estomago, y el intestino cuyas funciones digestivas altera. También puede originar diarrea crónica y cirrosis hepática, enfermedad en la cual el tejido normal del hígado es reemplazado por cicatrices fibrosas que impiden el cumplimiento de las importantes funciones de este órgano.
- Sistema Respiratorio: Causa neumonías, abscesos pulmonares.
- Sistema Circulatorio: produce insuficiencia cardiaca, alteraciones del ritmo de sus latidos, agrandamiento del corazón e hipertensión. Disminuye la actividad de los leucocitos y la resistencia de las enfermedades.
- Sistema Muscular: origina inflamaciones y calambres.
- Sistema Nervioso: provoca desinhibiciones, lentitud en los reflejos, incoordinación muscular, dificultades en la memoria, desorientación en el tiempo y espacio. Además ocasiona modificaciones en el carácter, con periodos de tristeza, de pereza, de irritabilidad y de violencia, pesadillas, alucinaciones nocturnas especialmente relacionadas con precipicios y con animales, monstruos que lo atacan.
- En la piel: causa dilatación capilar y le da un color rojo oscuro y un aspecto rugoso en la cara, especialmente en la nariz.
- En la visión: la alcoholemia excesiva estecla el campo visual, que normalmente es de uno 180º. Provoca así la “visión túnel” que impide al conductor percibir los vehículos las personas que se aproximen a ambos lados trasversales.
El Metanol, se utiliza como disolvente, anticongelante, desnaturalizante del “alcohol de quemar” y para la fabricaron de barnices, plásticos, y otros compuestos orgánicos. Hace un tiempo se experimento que con dosis muy pequeñas de Metanol disueltas en agua se obtiene muchos beneficios en plantas de clasificación C3 y en condiciones de cálidas y soleadas. Esta solución facilitaba el crecimiento de cosechas más frecuentes y mayores, minimizaba el uso de agua en el riego y una reducción en el uso de plaguicidas
El Etanol, además de utilizarse para la producción de bebidas alcohólicas, su fin esta destinado a el uso industrial y se emplea como disolvente en farmacia, perfumería y en compuestos orgánicos.
El Propanol, se utiliza como un antiséptico aún más eficaz que el alcohol etílico; es usado como un disolvente importante, su uso ams común es en forma de quitaesmalte. Además se utiliza como desnaturalizante, generalmente mezclado con otros compuestos.
Estructura Química De Los Alcoholes
Dependiendo de la sustitución del carbono al que se une el grupo hidroxilo, un alcohol será:

Nomenclatura
|
Modelo molecular
|
Descripción
|
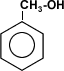
CH3OH
Metanol
|  |
Se denomina alcohol de madera porque se obtiene de ella por destilación seca. Se utiliza como disolvente para pinturas y como combustible. Es muy venenoso y produce ceguera cuando se ingieren o inhalan pequeñas cantidades. Una dosis de 30 mL resulta letal. Metabolicamente se transforma en formaldehído y ácido fórmico que impide el transporte de oxígeno en la sangre.
|
CH3CH2OH
Etanol
|  |
Se obtiene por fermentación de carbohidratos (azúcares y almidón). La fermentación se inhibe al producirse un 15% de alcohol. Para conseguir licores es necesaria la destilación (forma un azeótropo con el agua de composición 95:5 alcohol/agua). Para evitar el consumo se adicionan sustancias desnaturalizadoras. Es muy venenoso y produce la muerte a concentraciones superiores al 0.4% en sangre. Se metaboliza en el hígado a razón de 10 mL/hora. Se utiliza como antídoto contra el envenenamiento por metanol o etilenglicol.
|

Isopropanol
|  |
Se mezcla con agua y todos los disolventes orgánicos. Se emplea como antihielo, disolvente, limpiador, deshidratante, agente de extracción, intermedio de síntesis y antiséptico. Es un producto tóxico por vía oral, inhalación o ingestión.
|

Etilenglicol
| 
Enlace de hidrógeno intramolecular en verde
|
Recibió el nombre de glicol porque Wurtz, que lo descubrió en 1855, notó un cierto sabor dulce. Se utiliza como disolvente, anticongelante, fluido hidráulico, intermedio de síntesis de explosivos, plastificantes, resinas, fibras y ceras sintéticas. Es tóxico por ingestión.
|

Glicerina
|  |
Descubierta en 1779 por Scheele. Su nombre también proviene de su sabor dulce. Es una sustancia muy viscosa, soluble en el agua y no tóxica. La hidrólisis alcalina de triglicéridos (grasas) produce glicerina y jabones. El nitrato triple es la nitroglicerina, explosivo de enorme potencia.
|
Propanona
|  |
Conocida popularmente con el nombre de acetona, es un líquido incoloro de olor característica, utilizado para quitar el esmalte de las uñas, pero en general es un disolvente de pinturas, barnices y lacas.
|
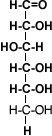
Ácido Láctico
|  |
El Ácido láctico, presente en los derivados de la leche. Este compuesto es sintetizado por nuestro metabolismo: todos hemos podido comprobar la olor característica de pies sudados a causa de la presencia de este ácido.
|
 |  |
El fenol es un compuesto utilizado en la fabricación de herbicidas, desinfectantes, colorantes, resinas... También interviene en el proceso de producción de la aspirina.
|
C6H12O6
Glucosa
|  |
Es el azúcar principal en el metabolismo humano.
|
Bibliografía:
Éteres
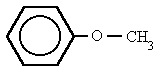
Es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, estando el átomo de oxígeno unido y se emplean pasos intermedios:
- ROH + HOR' → ROR' + H2O
Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH.
- RO- + R'X → ROR' + X-
Al igual que los ésteres, no forman puentes de hidrogeno. Presentan una alta hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser utilizados como disolventes orgánicos.
Suelen ser bastante estables, no reaccionan fácilmente, y es difícil que se rompa el enlace carbono-oxígeno. Normalmente se emplea, para romperlo, un ácido fuerte como el ácido yodhídrico, calentando, obteniéndose dos halogenuros, o un alcohol y un halogenuro. Una excepción son los oxiranos (o epóxidos), en donde el éter forma parte de un ciclo de tres átomos, muy tensionado, por lo que reacciona fácilmente de distintas formas.
El enlace entre el átomo de oxígeno y los dos carbonos se forma a partir de los correspondientes orbitales híbridos sp³. En el átomo de oxígeno quedan dos pares de electrones no enlazantes.
Los dos pares de electrones no enlazantes del oxígeno pueden interaccionar con otros átomos, actuando de esta forma los éteres como ligandos, formando complejos. Un ejemplo importante es el de los éteres corona, que pueden interaccionar selectivamente con cationes de elementos alcalinos o, en menor medida, alcalinotérreos.
Propiedades Físicas De Los Éteres
Los éteres presentan unos puntos de ebullición inferiores a los alcoholes, aunque su solubilidad en agua es similar. Dada su importante estabilidad en medios básicos, se emplean como disolventes inertes en numerosas reacciones.
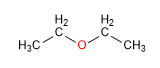
La importante solubilidad en agua se explica por los puentes de hidrógeno que se establecen entre los hidrógenos del agua y el oxígeno del éter.
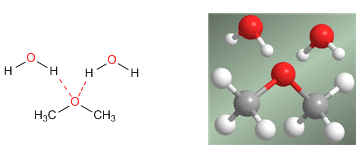
- Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
![[small][AnimePaper]wallpapers_Ergo-Proxy_Tenken-the-2nd(1_33)__THISRES__73653 [small][AnimePaper]wallpapers_Ergo-Proxy_Tenken-the-2nd(1_33)__THISRES__73653](http://kira2629.files.wordpress.com/2009/06/smallanimepaperwallpapers_ergo-proxy_tenken-the-2nd1_33__thisres__73653.jpg?w=477&h=86)
- La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclo propano.
Cuclo propano
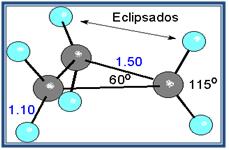
Epóxido de etileno
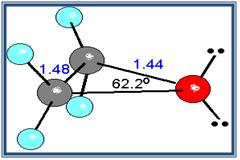
- Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
Propiedades Químicas De Los Éteres
- Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
- En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
- Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
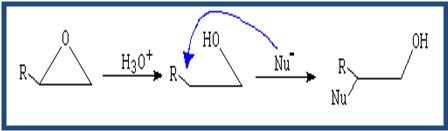
(Apertura catalizada por ácido) El nucleófilo ataca al carbono más sustituido.
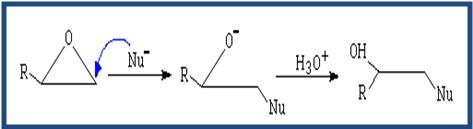 ( Apertura por neoclófilo) El neoclófilo ataca al carbono menos sustituido.
( Apertura por neoclófilo) El neoclófilo ataca al carbono menos sustituido.
No tienen hidrógenos activos como en los casos de los alcoholes o ácidos. Por este motivo son inertes ante metales como el sodio o potasio o litio. Necesitan del calor para descomponerse y ahí si poder reaccionar con algunos metales.
CH3 — CH2 –O–(CH2)2— CH3 + 2 Na —–> CH3 — CH2 O Na + CH3 — CH2 — CH2 Na
Etano oxi Propano Etanolato de sodio sodio propilo
Oxidación: Ante agentes oxidantes fuertes como el Dicromato de potasio, los éteres se oxidan dando aldehídos.
CH3 — CH2 —O—(CH2)2— CH3 —-> CH3 — HC = O + CH3 — CH2 — HC = O + H2O
Etano oxi Propano O2 Etanal Propanal
Utilidades De Los Éteres
Suelen ser utilizados como anestésicos, son sustancias que duran poco a temperatura ambiente, puesto que se evaporan con fácilidad casi como un alcohol etílico pero son más rápidos. pueden ser nocivos para la salud si se administran en dosis masivas.
-Anestésicos.
-Medio de arrastre para la deshidratacion de alcoholes isopropilicos y etílicos.
-Disolvente de sustacias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
-Combustible inicial de motores diésel.
-Fuertes pegamentos.
-Antinflamatorio abdominal para después del parto, solo uso externo.
Riesgos Y Beneficios De Los Éteres
¿Qué les sucede a los PBDEs cuando entran al medio ambiente?
•Los PBDEs entran al aire, al agua y al suelo durante su manufactura y uso en productos de consumo.
•En el aire, los PBDEs pueden encontrarse como partículas que eventualmente se depositan en el suelo o el agua.
•La luz solar puede degradar algunos PBDEs.
•Los PBDEs no se disuelven fácilmente en agua, pero se adhieren a partículas y se depositan en el fondo de ríos o lagos.
•Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones.
•Los PBDEs entran al aire, al agua y al suelo durante su manufactura y uso en productos de consumo.
•En el aire, los PBDEs pueden encontrarse como partículas que eventualmente se depositan en el suelo o el agua.
•La luz solar puede degradar algunos PBDEs.
•Los PBDEs no se disuelven fácilmente en agua, pero se adhieren a partículas y se depositan en el fondo de ríos o lagos.
•Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones.
¿Cómo puede ocurrir la exposición a los PBDEs?
•Las concentraciones de PBDEs en la sangre, leche materna y tejido graso de seres humanos indican que la mayoría de la gente está expuesta a concentraciones bajas de PBDEs.
•Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs.
•Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal.
•También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs.
•Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs.
•Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal.
•También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs.
¿Cómo pueden afectar mi salud los PBDEs?
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.
Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.
Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
¿Qué posibilidades hay de que los PBDEs produzcan cáncer?
No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales.
Estructura Química De Los Éteres
Cuando el grupo oxa del éter está unido a dos radicales alquilo o arilo, sin ningún otro grupo funcional, se acostumbra nombrar los radicales y al final la palabra éter. Si los radicales son iguales el éter se dice que es simétrico o simple y si no es entonces asimétrico o mixto. Esta nomenclatura es de tipo común, pero por acuerdo ordenamos los radicales en orden alfabético.
Ejemplos:
Éteres simétricos:
DITER-BUTIL ÉTER
|
DI-n-PROPIL ÉTER
|
 | |
DIETIL ÉTER
|
DIISOPROPIL ÉTER
|
 |  |
Éteres asimétricos
 |  |
ISOBUTIL METIL ÉTER
|
n-BUTIL-n-PROPIL ÉTER
|
 |  |
SEC-BUTIL ETIL ÉTER
|
FENILISOBUTIL ÉTER
|
Bibliografia:
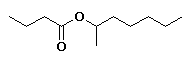
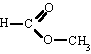
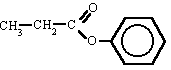
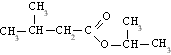
Ésteres
Son compuestos químicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetatod de etilo.
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster
(éster de ácido carboxílico)
| Éster carbónico
(éster de ácido carbónico)
| Éster fosfórico
(triéster de ácido fosfórico)
| Éster sulfúrico
(diéster de ácido sulfúrico)
|
|---|---|---|---|
 |  |  | 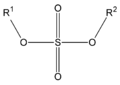 |
Propiedades Físicas De Los Éteres
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
- Acetato de 2 Etil Hexilo: olor a dulzón suave
- butanoato de metilo: olor a Piña
- salicilato de metilo (aceite de siempreverde o menta): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
- octanoato de heptilo: olor a frambuesa
- etanoato de isopentilo: olor a plátano
- pentanoato de pentilo: olor a manzana
- butanoato de pentilo: olor a pera o a albaricoque
- etanoato de octilo: olor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
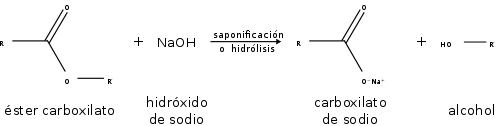
Propiedades Químicas De Los Éteres
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.2 La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3reflujado con THF.3
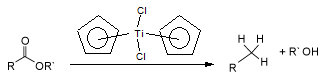
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.4 El mecanismo probablemente se debe a la formación de un alqueno intermediario.
El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como la condensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchos métodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
Usos De Los Ésteres
Muchos ésteres tienen un olor característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
* metil butanoato: olor a piña
* metil salicilato (aceite de siempreverde): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
* etil metanoato: olor a frambuesa
* pentil etanoato: olor a plátano
* pentil pentanoato: olor a manzana
* pentil butanoato: olor a pera o a albaricoque
* octil etanoato: olor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico.
* metil butanoato: olor a piña
* metil salicilato (aceite de siempreverde): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
* etil metanoato: olor a frambuesa
* pentil etanoato: olor a plátano
* pentil pentanoato: olor a manzana
* pentil butanoato: olor a pera o a albaricoque
* octil etanoato: olor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico.
Los ésteres son empleados en muchos y variados campos del comercio y de la industria, como los siguientes:
|






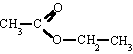
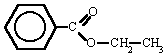
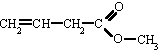
No hay comentarios:
Publicar un comentario